AGOTAMIENTO DE SUELO
Cada vez resulta más evidente que diversas actividades del hombre han derivado en una situación, en que la tasa de pérdida de suelo supera por mucho al de su formación, desestabilizando peligrosamente su equilibrio natural.
a. Deforestación: es el desmonte de terrenos con el fin de utilizarlos para cultivos, explotaciones madereras o zonas de pastoreo para ganado.
b. Erosión: proceso físico que consiste en el desprendimiento y arrastre de las partículas del suelo por los agentes del intemperismo. La erosión causada por el agua se llama erosión hídrica y la causada por el viento erosión eólica.
c. Salinización: deterioro de los suelos por el incremento en el nivel de sales solubles que reduce su capacidad productiva.
d. Degradación física: se produce como consecuencia de procesos como el encostramiento, la reducción de permeabilidad, la compactación, la cementación y la degradación de la estructura.
e. Degradación biológica: Consiste en el aumento de la velocidad de mineralización de la materia orgánica, como consecuencia del continuo paso del arado que aumenta la intemperización y afecta la estructura de ésta.
g. Asentamientos humanos: la expansión urbana puede conducir al más fuerte cambio de uso del suelo; la sustitución de la cobertura vegetal por la cubierta asfáltica reduce la filtración de agua, afectando la cubierta vegetal aledaña y, con ello, acelera el proceso de degradación del suelo.
La degradación del suelo reviste gran importancia, porque su regeneración es en extremo lenta. En zonas agrícolas tropicales y templadas, se requiere de un promedio de 500 años para la renovación de 2,5 centímetros de suelo.
EN MÉXICO, SE HA DEMOSTRADO QUE, EN DIFERENTES MEDIDAS, ALREDEDOR DE 97% DEL SUELO ESTÁ AFECTADO POR ALGÚN PROCESO DE DEGRADACIÓN.
Los efectos de la degradación del suelo son numerosos: deterioro de la flora y de la fauna, desequilibrio del ciclo hidrológico, disminución de la diversidad, mengua de la capacidad alimentaria y maderera, contaminación, inundaciones y azolve de infraestructura, etc.; pero uno de los efectos más graves es la desertificación, que posteriormente se tratara.
Urbanización:
La urbanización es el avance y crecimiento de las ciudades y la edificación de nuevos centros de población, las que generalmente se ubican sobre suelo fértil. De esta forma se pierde el mejor suelo agrícola, se impide la recarga de los depósitos de agua subterránea y se destruye mucha microflora y microfauna que vive en el suelo. Una gran parte de los suelos con alto potencial agrícola de muchos países se encuentran dentro de límites urbanos y el rápido crecimiento de las manchas urbanas, amenaza las tierras productivas.
Contaminación de suelos.
El daño que se causa a los suelos es de la misma magnitud que el que se causa al agua y al aire, aunque en realidad algunas veces es menos evidente para nosotros; sin embargo, es importante conocer los lugares donde es más probable que se contamine el suelo. Algunos de estos sitios son los parques industriales, los basureros municipales, las zonas urbanas muy pobladas y los depósitos de químicos, combustibles y aceites, etc., sin dejar de mencionar las zonas agrícolas donde se utilizan los fertilizantes o pesticidas de manera excesiva.
Dentro de los contaminantes de suelos se encuentran los residuos antropogénicos, cuyo origen puede ser doméstico, industrial, de hospitales o de laboratorios. Independientemente de su origen, los residuos pueden ser peligrosos o no peligrosos.
Los peligrosos son aquellos que por sus características corrosivas, reactivas, explosivas, tóxicas, inflamables o biológicas, representan un riesgo para la salud del hombre y el ambiente, mientras que los residuos no peligrosos se denominan residuos sólidos.
Los residuos sólidos pueden ser clasificados como degradables o no degradables, considerándose un residuo degradable aquel que es factible de descomponerse físicamente; por el contrario, los no degradables permanecen sin cambio durante periodos muy grandes.
Es importante mencionar que la deposición de los residuos sólidos (degradables y no degradables) implica responsabilidad y cuidado por parte de los ciudadanos de este planeta.
Los problemas generados por la erosión eólica e hídrica rebasan los efectos in situ, extendiéndose a la agricultura productiva, las comunicaciones y las poblaciones de la región,
Manejo y conservación del suelo.
Para el manejo y conservación del suelo se ofrecen diversas alternativas, como la labranza de conservación, limitada o agricultura sin labranza y agro silvicultura y la adecuada planeación de los centros de población, así como también el manejo adecuado de residuos producidos por los mismos y los residuos de la industria en general.
Fertilizantes
Una vez que ha iniciada la 'revolución verde' con el desarrollo de una amplia tecnología para el cultivo, en busca de mayor productividad en menos área, los suelos naturales son incapaces de brindar la cantidad suficiente de nutrientes para sostener cultivos intensivos y, la mayoría de las veces, monocultivos.
La fertilidad de los suelos ha bajado en buena proporción debido al excesivo cultivo en algunos países, y a la pérdida de suelo por erosión, por la contaminación o por la expansión de la mancha urbana. En la República Mexicana predomina la fertilidad media para suelos agrícolas y la alta está reducida a sólo un estado.
El uso de fertilizantes nitrogenados y fosforados va en aumento y la producción agroecológica o sustentable como método general, es todavía un propósito a largo plazo. La síntesis química de fertilizantes químicos crece como una gran industria que surte de grandes cantidades de abonos químicos a los campesinos.
El uso de fertilizantes nitrogenados y fosforados va en aumento y la producción agroecológica o sustentable como método general, es todavía un propósito a largo plazo. La síntesis química de fertilizantes químicos crece como una gran industria que surte de grandes cantidades de abonos químicos a los campesinos.
El abono natural obtenido de materia orgánica en descomposición (guano, estiércol, etc) es sustituido en buena parte del mundo. Compañías transnacionales se encargan de la producción masiva de abonos químicos y su venta a los países en desarrollo.
Sólo en EUA se llegan a utilizar más de 100 kg de fertilizantes al año por hectárea y en Canadá alrededor de 50 kg. En el mundo se han llegado a utilizar más de 145 millones de toneladas de fertilizantes al año (entre 1985-1990)
La incapacidad de dar a cada planta sólo los nutrientes que requieren y consumen es una limitante muy importante. Todos los días se adiciona a los campos de cultivo, más fertilizantes químicos que los que requiere. Los excedentes son arrastrados por el viento y la lluvia, hacia los arroyos, llegando a los ríos y al mar, produciendo lo que conocemos como eutroficación.
Se conoce como fertilizante a una sustancia que se agrega al suelo para suministrar aquellos elementos que se requieren para la nutrición de las plantas. Un material fertilizante o transportador es una sustancia que contiene uno o más de los elementos esenciales para las plantas. Los fertilizantes completos contienen los tres elementos mayores nutrientes para las plantas: nitrógeno, fósforo y potasio.
Los fertilizantes mezclados son una combinación mecánica o química de dos o más materiales fertilizantes y que contiene dos o más elementos esenciales.
Existen fertilizantes formadores de ácido los cuales son capaces de aumentar la acidez del suelo, lo que proviene principalmente de la nitrificación de las sales amónicas por las bacterias del suelo. Los fertilizantes básicos o alcalinos disminuyen la acidez del suelo, mientras que los fertilizantes neutros o no formadores de ácidos son aquellos que no aumentan ni disminuyen el pH al ser agregado a un suelo.
Los fertilizantes son adicionados con materiales de carga o rellenadores, que son materiales que se mezclan a un fertilizante para que una unidad dada proporcione los nutrientes señalados en el análisis y otros nutrientes distintos del nitrógeno, el fósforo o potasio.
Para regular la acción de los fertilizantes se pueden utilizar agentes neutralizantes. La piedra caliza dolomita se utiliza como neutralizador, siendo además fuente de magnesio. Es menos probable que la dolomita cause reversión del fosfato monocálcico que la calcita (CaCO3).
Las reacciones químicas en los fertilizantes mezclados dependen del contenido de humedad, temperatura y tamaño de las partículas.
Las reacciones químicas de doble descomposición ocurren entre dos compuestos, sin un ion común, en presencia de humedad, por ejemplo:
Ca(H2P O4)2 + (NH4)2SO4 -----> CaSO4 + 2 NH4H2PO4
Esta reacción es muy lenta se tarda aproximadamente 2 meses.
NH4NO3 + KCl -----> NH4Cl + KNO3
(NH4)2SO4 + 2 KCl -----> 2 NH4Cl + K2SO4
Reacción química de descomposición. En las mezclas de fertilizantes bajo ciertas condiciones algunos componentes pueden descomponerse como la urea:
(NH2)2CO + H2O -----> 2 NH3 + CO2
La descomposición de la urea se acelera al aumentar la temperatura, particularmente en presencia de compuestos como el fosfato monocálcico, dicálcico o monoamónico.
El fosfato diamónico se descompone por las altas temperaturas en el almacenamiento, de acuerdo a la ecuación:
(NH4)2HPO4 -----> NH4H2PO4 + NH3
Si la mezcla contiene sulfato cálcico, el amoníaco liberado no se pierde pero forma sulfato amónico o fosfato dicálcico, de acuerdo a la ecuación:
NH4H2PO4 + CaSO4 + NH3 -----> CaHPO4 + (NH4)2SO4
La amonización es de gran importancia en la industria de los fertilizantes por diversas razones como:
1. El amoníaco anhidro y las soluciones de amoníaco son formas económicas de proporcionar nitrógeno.
2. El amoníaco se combina con el superfosfato normal o triple y con los ácidos fosfórico, nítrico o sulfúrico.
3. Elimina la necesidad de usar grandes cantidades de ácidos si el amoníaco fuera transformado a sales como nitrato o sulfato de amonio.
4. Mejora la condición física de los fertilizantes mezclados.
5. El ácido libre en el superfosfato es neutralizado.
La química de las reacciones que se llevan a cabo en la amonización del superfosfato es algo compleja pero se pueden en las ecuaciones químicas:
Ca(H2PO4)2•H2O + NH3 -----> NH4H2PO4 + CaHPO4 + H2O (1)
2 NH3 + 2 CaHPO4 + CaSO4 -----> Ca3(HPO4 )2 + (NH4)2 SO4 (2)
NH4H2PO4 + NH3 -----> (NH4)2HPO4 (3)
3 CaHPO4 + 2 NH3 -----> Ca3(PO4)2 + (NH4)2HPO4 (4)
La reacción 8(1) indica la etapa inicial del proceso de amonización del superfosfato normal y de los concentrados. Si continúa la amonización hay una transformación del superfosfato a fosfato tricálcico no disponible y una subsecuente formación de fosfato amónico, como se indica en la ecuación (2). Las ecuaciones (3) y (4) representan las reacciones que ocurren cuando continúa la amonización del superfosfato concentrado.
CONTAMINACIÓN POR FERTILIZANTES
1. INTRODUCCIÓN
1.- INTRODUCCIÓN
Las plantas sintetizan sus alimentos a partir de elementos químicos que toman del aire, agua y suelo. Existen 60 elementos químicos constituyentes de las plantas, de los cuales 16 son esenciales y los podemos dividir como macronutrientes (primarios y secundarios) y micronutrientes u oligoelementos.
Aparte se encuentran el carbono, hidrógeno y oxígeno que los toman las plantas del aire y del agua. El CO2 y H2O representan en la práctica la única fuente de energía para sus reacciones de síntesis.
La diferencia que existe entre macronutrientes primarios y secundarios, es que para estos últimos, las cantidades existentes en los suelos son, en general, suficientes para los requerimientos que necesitan las plantas y son tomados directamente del suelo, sin que se produzcan normalmente deficiencias.
Una situación problemática bastante generalizada, es la que se deriva de la aplicación abusiva de fertilizantes en el suelo con el fin de aumentar el rendimiento de las cosechas, y en esos momentos los fertilizantes pierden su acción beneficiosa y pasan a ser contaminantes del suelo.
Los fertilizantes contienen N, P, K, bien por separado, o en productos formados por mezclas de diversos elementos. Pueden ser minerales (inorgánicos) u orgánicos.
En función de los nutrientes contenidos se les denomina: simples (con uno sólo de los elementos primarios) o compuestos (con 2 o los 3 elementos primarios). Se habla de fertilizantes complejos cuando contienen elementos mayoritarios junto a algunos minoritarios.
La riqueza representa la cantidad total de elementos nutritivos expresada en tanto por ciento en peso.
La formulación de fertilizantes sigue unas determinadas normas:
Para los compuestos (NPK):
- denominación: 8-24-16
- contenido: 8% de N, 24% P2O5 y 16% K2O
- riqueza: 8+24 +16 =48%
Para los complejos:
- denominación: 8-24-16-2Mg-0,2B
- contenido: 8% N, 24%P2O5, 16%K2O, 2%MgO y 0,2%B
- riqueza: 50,2%
2.- NITRÓGENO
Es un nutriente esencial para el crecimiento de los vegetales, ya que es un constituyente de todas las proteínas. Es absorbido por las raíces generalmente bajo las formas de NO3- y NH4+. Su asimilación se diferencia en el hecho de que el ión nitrato se encuentra disuelto en la solución del suelo, mientras que gran parte del ión amonio está adsorbido sobre las superficies de las arcillas. El contenido de nitrógeno en los suelos varia en un amplio espectro, pero valores normales para la capa arable son del 0,2 al 0,7%. Estos porcentajes tienden a disminuir acusadamente con la profundidad. El nitrógeno tiende a incrementarse al disminuir la temperatura de los suelos y al aumentar las precipitaciones atmósfericas.
Los aportes, transformaciones y pérdidas del nitrógeno en el suelo se esquematiza en el siguiente ciclo.
Como resultado en el suelo podemos encontrar nitrógeno orgánico (proteínico, ácidos nucleicos, azucares,...) e inorgánico (NH4+, NO3-, NO2- ...). Siendo, generalmente, el órganico el más abundante (85 al 95% son valores normales).
El nitrógeno asimilable procede de diversas fuentes y está sometido a pérdidas por diversos mecanismos.
Básicamente el ciclo del nitrógeno se compone de cuatro tipos de procesos:
1. Fijación del nitrógeno molecular. Puede realizarse bajo diferentes vías.
Fijación biológica simbiótica. El nitrógeno atmosférico es fijado por ciertos microorganismos en el suelo que actúan de manera simbiótica con las plantas (como plantas hospedadoras actuan, preferentemente, las leguminosas). El mecanismo es complejo, básicamente se admite que el N2 es transformado a NO3- por la actividad de bacterias del género rhizobium y es incorporado a estos organismos bajo la forma de aminoácidos. En ausencia de fertilizantes, éste es el proceso esencial para el crecimiento de las plantas.
Fijación biológica asimbiótica. Ciertos microorganismos pueden fijar nitrógeno sin recurrir a comportamientos simbióticos. Se trata de microorganismos heterótrofos frente al carbono y lo tienen que tomar de los azúcares, almidón, celulosas .... Son las bacterias heterótrofas, bacterias fotosintéticas y algas azules-verdes.
Fijación no biológica. El nitrógeno puede ser arrastrado directamente al suelo por las aguas de lluvia. Representa una vía muy poco importante frente a la fijación biológica.
2. Nitrificación.
Es el proceso correspondiente a la oxidación del ión amonio a nitrato. Se desarrolla en dos etapas. En un primer paso, el ión amonio es oxidado a nitrito (reacción catalizada por bacterias nitrosomas) y en la segunda fase el nitrito pasa a nitrato (por la acción de la bacteria nitrobacter).
3. Reducción del ión nitrato.
En ausencia de oxígeno (suelos saturados en agua) el nitrato evoluciona a amonio, interviniendo en el proceso reductor las bacterias nitrato-reductasa, siendo el nitrato el que actúa de aceptor de electrones en la oxidación de la materia orgánica.
4. Desnitrificación.
Es otro proceso de reducción del ión nitrato, pero esta vez a nitrógeno molecular. En suelos completamente saturados en agua se produce un empobrecimiento en oxígeno y algunos organismos anaeróbicos tienen capacidad de obtener el oxígeno de los nitratos y nitritos con liberación simultánea de nitrógeno y de óxido nitroso.
Inversamente el nitrógeno mineral puede ser utilizado por los microorganismos del suelo y ser transformado en nitrógeno orgánico. Esta transformación se llama inmovilización biológica.
2.1 Tipos de fertilizantes nitrogenados
El nitrógeno añadido como abono, puede estar como urea, NH4+ y NO3-. Este nitrógeno sigue los mismos modelos de reacción que el nitrógeno liberado por los procesos bioquímicos a partir de residuos de plantas.
· Así la urea es sometida a la amonificación (formación de NH4+) y nitrificación previas para su utilización por los microorganismos y plantas.
· El amonio puede ser oxidado a NO3- y ser fijado por las partículas sólidas del suelo o utilizado sin cambio por los microorganismos y las plantas.
· Los nitratos pueden ser absorbidos directamente por microorganismos y plantas o pueden perderse por volatilización y lavado.
2.2 Efectos secundarios del abonado nitrogenado
· Aportación de nutrientes, aparte del nitrógeno, como S, Mg, Ca, Na y B.
· Variación de la reacción el suelo (acidificación o alcalinización) .
· Incremento de la actividad biológica del suelo con importantes efectos indirectos sobre la dinámica global de los nutrientes.
· Daños por salinidad y contaminación de acuíferos, causados por una dosificación muy alta.
· Daños causados por las impurezas y productos de descomposición.
· Efecto secundario, herbicida y fungicida, de la cianamida cálcica.
2.3 Impacto ambiental del exceso de fertilizantes nitrogenados
Las sales de nitrato son muy solubles, por lo que la posibilidad de que se produzca la lixiviación del anión es elevada y más teniendo en cuenta el bajo poder de adsorción que presentan la mayoría de los suelos para las partículas cargadas negativamente.
El problema ambiental más importante relativo al ciclo del N, es la acumulación de nitratos en el subsuelo que, por lixiviación, pueden incorporarse a las aguas subterráneas o bien ser arrastrados hacia los cauces y reservorios superficiales. En estos medios los nitratos también actúan de fertilizantes de la vegetación acuática, de tal manera que, si se concentran, puede originarse la eutrofización del medio. En un medio eutrofizado, se produce la proliferación de especies como algas y otras plantas verdes que cubren la superficie. Esto trae como consecuencia un elevado consumo de oxígeno y su reducción en el medio acuático, así mismo dificulta la incidencia de la radiación solar por debajo de la superficie. Estos dos fenómenos producen una disminución de la capacidad autodepuradora del medio y una merma en la capacidad fotosintética de los organismos acuáticos.
La lixiviación de nitratos hacia el subsuelo puede contaminar los acuíferos subterráneos, creando graves problemas de salud si se consume agua rica en nitratos, debido a su transformación en nitritos por participación de unas bacterias existentes en el estómago y vejiga urinaria. A su vez los nitritos se transforman en ciertos compuestos cancerigenos (Nitrosaminas), que afectan al estómago e hígado.
La cantidad de nitratos que se lixivia hacia el subsuelo depende del régimen de pluviosidad y del tipo del suelo. La mayoría de los suelos poseen abundantes partículas coloidales, tanto orgánicas como inorgánicas, cargadas negativamente, con lo que repelerán a los aniones, y como consecuencia, estos suelos lixiviaran con facilidad a los nitratos. Por el contrario, muchos suelos tropicales adquieren carga positiva y por tanto, manifiestan una fuerte retención para los nitratos.
La textura de los suelo es un factor importante en relación con la lixiviación. Cuanto más fina sea la textura más capacidad de retención presentarán.
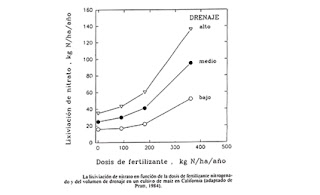
En la siguiente figura se muestra como al aumentar la dosis de fertilizante aumenta la lixiviación de los nitratos.
Por otra parte, para una misma dosis de fertilizante nitrogenado, por ejemplo 200 Kg/ha, la lixiviación es mayor cuando el suelo presenta un drenaje más alto. Así mismo, podemos evaluar el exceso de N que se puede producir en función de la cantidad de N fertilizante aplicado y del drenaje del suelo.
En las siguiente figura se muestra la reacción de los cultivos frente a la fertilización con nitrógeno, así como su distribución en la planta y en el suelo.
3.- FÓSFORO
Es después del nitrógeno, el segundo elemento en importancia para el crecimiento de las plantas. La falta de este elemento en el suelo, puede impedir que otros sean absorbidos por las plantas (por ejemplo, las leguminosas necesitan determinada cantidad de fósforo para poder fijar nitrógeno).
3.1 Ciclo del fósforo en la naturaleza.
El ciclo del fósforo en el suelo se esquematiza a continuación.
En la siguiente figura se representan las ganancias y pérdidas del fósforo asimilable en el suelo.
3.2 Formas de fósforo.
Desde el punto de vista químico el fósforo puede encontrarse como:
· Fósforo inorgánico.
· Fósforo orgánico.
· Fósforo adsorbido.
· Fósforo asimilable.
La disponibilidad está determinada por los siguientes factores:
· pH del suelo
· Fe, Al, y Mn solubles
· Presencia de minerales que contienen Fe, Al y Mn.
· Minerales de calcio y magnesio disponibles
· Cantidad y descomposición de materia orgánica
· Actividad de microorganismos
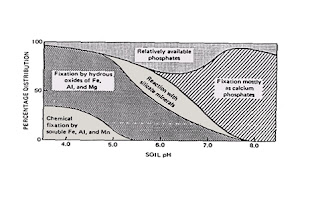
Todos estos factores están influenciados por el pH de suelo. La máxima disponibilidad del P ocurre para pH entre 6 y 7.
A pH bajos, suelos ácidos, existe en solución Fe, Al y Mn que reaccionan con el ácido fosfórico dando fosfatos hidróxidos insolubles. También existe la fijación por los óxidos hidróxidos formando fosfatos hidróxidos insolubles. La fijación por silicatos-arcillas, se realiza en condiciones de moderada acidez.
En suelos alcalinos, los fosfatos precipitan con el Ca de cambio y con el de CaCO3.
La dependencia del comportamiento del fósforo con el pH se resume a continuación:
a pH = 3-4. Mínima solubilidad.
a pH > 4 el fósforo disminuye la capacidad fijadora.
a pH = 5,5 mucho del fósforo está químicamente combinado con Fe y Al.
a pH = 6 comienza la precipitación como fosfato cálcico
a pH = 6,5 se forman sales de Ca insolubles por lo que el fósforo no es disponible.
a pH > 7 puede formarse incluso apatito como ejemplo de compuestos muy insolubles.
Generalmente los fosfatos forman compuestos insolubles con iones Fe+3 y Al+3 en medio ácido y con Ca++ en medios alcalinos. Tan solo existe un rango de pH (alrededor de 6,5) en el que el fosfato se mantiene soluble, que es la situación en la que se puede presentar cierto riesgo de lixiviación.
3.3 Efectos secundarios de abonos fosfatados.
· Aportación de nutrientes, además del fósforo, como el azufre, calcio, magnesio, manganeso y otros; así como sustancias inútiles, desde el punto de vista de la fertilidad, sodio y sílice.
· Aportación de sustancias que mejoran la estructura: cal y yeso.
· Variación del pH del suelo.
· Inmovilización de metales pesados.
3.4 Impacto ambiental de los abonos fosfatados.
El problema ambiental de los fosfatos es, como el del N, la eutrofización de las aguas.
4.- POTASIO
Este elemento alcanza en la litosfera una concentración media de 1,58%. La mayor parte de sus sales son muy solubles. Es un elemento muy adsorbido por los minerales arcillosos 2:1 (fundamentalmente las micas).
4.1 Ciclo del potasio
4.2 Formas de potasio
Atendiendo a la disponibilidad del K en el suelo, puede ser clasificado en dos grupos:
· Potasio cambiable o asimilable. Este K puede ser absorbido por las raíces de las plantas. Se presenta bajo dos formas:
* K rápidamente disponible en la solución del suelo.
* K lentamente disponible. Adsorbido a la superficie del complejo arcillo húmico.
· Potasio no cambiable. Fijado en el interior de las arcillas (ilitas) en forma no cambiable o que se libera muy lentamente a medida que el suelo se empobrece en potasio de cambio. También el contenido en los minerales de la roca madre, que se liberará a través de los procesos de meteorización.
Como todas las formas cambiables, el K cambiable se encuentra en equilibrio con el K adsorbido y con el de la solución del suelo.
K no cambiable <==> K cambiable <==> K en solución.
El potasio asimilable está sometido a una serie de mecanismos que regulan su presencia en los suelos.
4.3 Efectos secundarios de abonos potásicos.
· Impureza en forma de aniones.
· Impureza en forma de cationes.
· Efecto salinizante, producido por las impurezas de los abonos potásicos, fundamentalmente los cloruros.
A continuación se resumen los mecanismos de pérdida de los macronutrientes en el suelo.
5.- MACRO NUTRIENTES SECUNDARIOS
Son aquellos elementos nutritivos que las plantas necesitan absorber en gran cantidad y que normalmente abundan en todos los suelos. A este grupo pertenece el Ca, Mg y S.
5.1 Efecto de exceso de azufre, calcio y magnesio en el medio ambiente
El magnesio. Los efectos secundarios de los abonos magnésicos, son de poca importancia. Se debe especialmente evitar que se apliquen grandes cantidades de MgCl2 a las plantas sensibles al cloro.
El calcio se utiliza para enmiendas, para mejorar la estructura del suelo, más que como fertilizante y para elevar el pH.
El azufre tiene varios efectos:
· Efecto tóxico del SO2 sobre las plantas.
· Efecto acidificante del SO2 en la lluvia ácida. Con lo que se acidifica el suelo, debido fundamentalmente a la liberación de Al+++ (soluble hasta pH < 4,5) que es un elemento altamente tóxico para las plantas.
· Efectos sobre los suelos que son normalmente deficientes en S.
· En algunas regiones una alternativa o fuente adicional de la acidez proviene de las minas de carbón y otros minerales que puedan dejar al descubierto cantidades significantes de pirita, que expuesta al aire se oxida y una consecuencia es la liberación de H2SO4 en las vías fluviales.
6.- OLIGOELEMENTOS
Se refiere a un elemento que es requerido en pequeñas cantidades por las plantas o animales pero que su disponibilidad es completamente necesaria para que los organismos completen su ciclo vital.
6.1 Ciclo de los oligoelementos
Las fases solubles de los oligoelementos se pueden encontrar en forma iónica o bien quelatada, siendo fácilmente absorbibles por las plantas. Los oligoelementos de la solución del suelo, en parte se pueden inmovilizar por complejación con sustancias húmicas insolubles o a través de la fijación sobre las superficies de los minerales de la arcilla o de los óxidos. Por otra parte los residuos de las plantas, por descomposición, liberan oligoelementos y moléculas orgánicas quelatantes, moléculas que pueden mantenerlos en solución, así como favorecer la solubilización de las formas insolubles. Por último una fracción es exportada del ciclo mediante las cosechas.
6.2 Fuentes de oligoelementos en el suelo
Los oligoelementos presentes en los suelos proceden fundamentalmente de:
ü Del material original (rocas y minerales) que ha dado lugar al suelo.
ü Impurezas en fertilizantes, productos de encalado, plaguicidas y aguas residuales.
ü Residuos industriales, productos de combustión de materiales fósiles, materiales volcánicos y en fin, aportaciones por las precipitaciones.
6.3 Formas de oligoelementos en el suelo
Los oligoelementos del suelo los podemos encontrar como:
ü Soluble en agua.
ü Catión de cambio.
ü Forma complejada por la materia orgánica, incluyendo residuos de plantas y organismos vivos, biomasa.
ü Forma ocluida en óxidos de Fe y Mn.
ü Como minerales primarios y formando parte de arcillas por sustituciones isomórficas del Fe y Al de las capas octaédricas.
6.4 Necesidades de oligoelementos en las plantas
Una característica común a todos los oligoelementos es el hecho de que a partir de una determinada concentración, una vez superado el rango óptimo, toda cantidad adicional se vuelve tóxica para las plantas incluso llegando a un rango en el que la concentración es letal.
6.5 Disponibilidad
La disponibilidad va a estar regulada por el pH, que va a modificar su comportamiento en el suelo según su solubilidad, adsorción e inmovilidad.
7.- ABONOS ORGÁNICOS
Constituyen un grupo muy diverso de materiales procedentes de residuos de animales y vegetales más o menos transformados y que presentan unos altos contenidos en materia orgánica.
7.1 Tipos de abonos orgánicos.
Principalmente: estiércol sólido, purín, estiércol semilíquido, paja, compost y abono verde.
o Estiércol sólido
Se compone fundamentalmente de excrementos de animales domésticos y una pequeña cantidad de orina y paja. Contiene N orgánico y amoniacal, fósforo, potasio y micronutrientes como Cu, Zn, Fe y Mn.
o Estiércol líquido, purines
Está constituido por orina fermentada de los animales domésticos, mezclada con partículas de excrementos, jugos que fluyen del estiércol y agua de lluvia.
Por su importante contenido en sales potásicas el purín es considerado como un abono N-K. Es un abono de efecto rápido, ya que los nutrientes que contiene se encuentran en su mayor parte en forma fácilmente disponible. La aplicación en dosis elevadas de residuos líquidos puede conducir a la salinización del suelo.
o Estiércol semi-líquido
Se trata de una mezcla de excrementos y orina, a la que se le añade agua para facilitar su transporte y distribución.
o Paja
La paja es pobre en nutrientes, pero suministra materia orgánica degradable, por ejemplo celulosa, lo que constituye una fuente energética.
Dado que la descomposición de la paja es lenta, esta debe enterrarse con gran antelación a la siembra.
o Compost
Es un producto de descomposición de residuos vegetales y animales, con diversos aditivos. Este grupo es el más amplio de los abonos orgánicos; comprende desde materiales sin ninguna calidad, procedente de los basureros, hasta sustratos perfectamente preparados con alto poder fertilizante.
o Abono verde
Se utilizan plantas enteras, o solamente residuos, como las raíces.
El efecto del abonado verde consiste en la aportación de nitrógeno, de materia orgánica, así como la mejora de la estructura del suelo, y por último contribuye con gran cantidad de nutrientes asimilables, facilitando la movilidad de fosfatos y oligoelementos.
Se utilizan fundamentalmente leguminosas, dada su propiedad fijadora de nitrógeno y otras plantas verdes como cereales y leguminosas.
CCH VALLEJO
Mendoza Cruz Daniela
Mendoza Ramírez Aurora
Gpo. 206
Trabajo de Investigación:
‘Agotamiento de suelo,
Fertilizantes y Abonos’
Marzo 2011











No hay comentarios:
Publicar un comentario